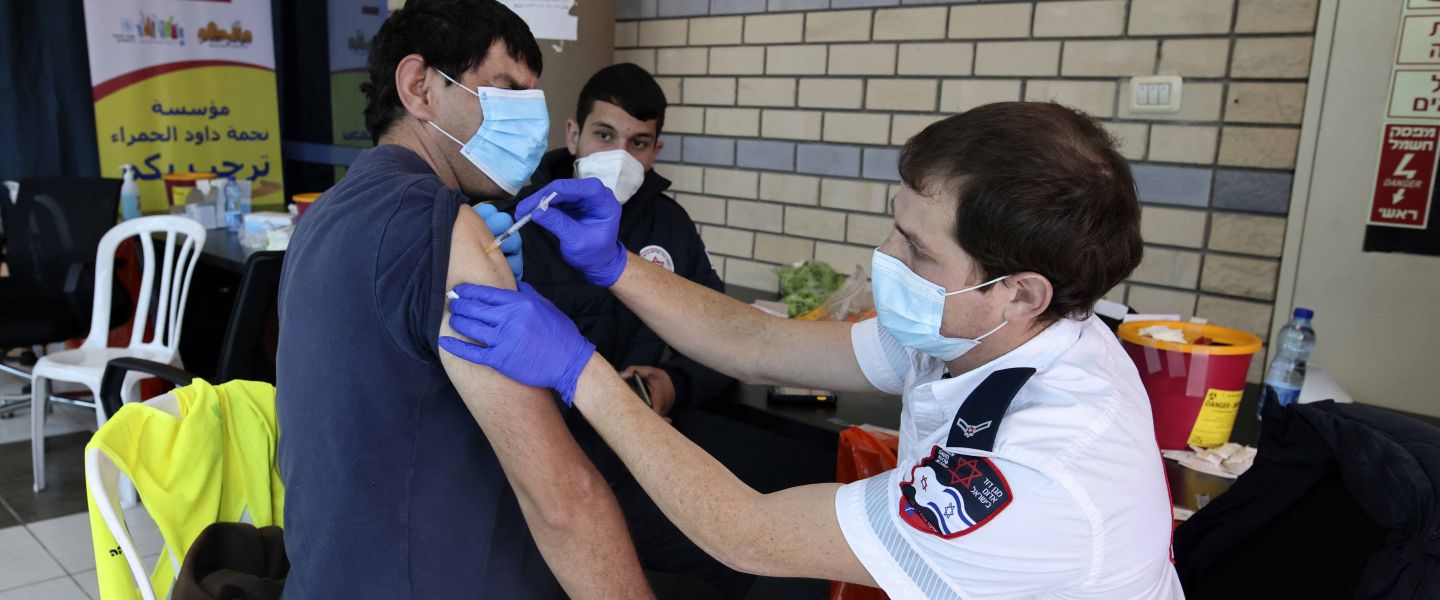
L’alliance Pfizer-BioNTech va proposer une troisième dose de son vaccin contre la Covid-19 aux participants israéliens de leur essai clinique initial, afin d’évaluer son effet possible sur un renforcement immunitaire face aux variants du virus.
Les sociétés américaine et allemande de biotechnologie « vont étudier les effets d’une troisième dose du vaccin Pfizer/BioNTech, pour évaluer la sécurité et la façon dont est tolérée une piqûre de rappel », face aux inquiétudes suscitées par les variants du SARS-CoV-2, ont annoncé les deux entreprises.
Les participants de la phase 1 de leur essai clinique aux Etats-Unis se verront ainsi offrir une troisième dose « 6 à 12 mois » après avoir reçu les deux premières, « dans le cadre de la stratégie de développement clinique des deux entreprises pour évaluer l’efficacité d’une troisième dose contre les variants » en circulation ou futurs.
Pfizer et BioNTech précisent également être en « discussions avec les autorités de régulation » pour soumettre une version modifiée de leur vaccin « avec une séquence spécifique aux variants ».
Le variant sud-africain est considéré par les scientifiques comme l’un des plus préoccupants car il a montré qu’il pouvait en partie contrer les défenses immunitaires développées après certains traitements.
Les deux entreprises rappellent toutefois n’avoir pas observé de changement dans les « niveaux d’anticorps » après injection de la formule initiale de leur vaccin face aux variants, et donc aucune « réduction significative de la protection apportée » par les deux doses classiques.
L’efficacité du vaccin Pfizer/BioNTech a par ailleurs été confirmée par une étude de très grande ampleur réalisée en Israël et publiée mercredi.
Selon cette étude, l’efficacité est de 94% contre les cas symptomatiques de Covid-19.
Elle a été menée à partir des données de quelque 1,2 million de personnes soignées alors que le variant britannique circulait largement dans le pays, ce qui confirme l’efficacité du vaccin contre ce variant-ci.
La société de biotechnologie américaine Moderna, à l’origine de l’autre vaccin autorisé aux Etats-Unis, a de son côté annoncé mercredi qu’une version modifiée de son vaccin, développée spécifiquement contre le variant sud-africain, était prête à être testée sur des humains dans le cadre d’essais cliniques.
« Nous devons êtres vigilants et proactifs au sujet des nouveaux variants », avait souligné Stéphane Bancel, patron de Moderna.
L’Agence américaine des médicaments (FDA) avait indiqué lundi que les fabricants n’auraient pas à conduire de nouveau les longs essais cliniques pour les versions modifiées de leurs vaccins déjà autorisés, mais des tests moins poussés, ce qui devrait grandement accélérer leur mise sur le marché en cas de résultats concluants.
C’est ce qui se produit déjà, par exemple, pour les versions modifiées des vaccins contre la grippe chaque année.
Source Challenge


Laisser un commentaire